¿Escaleras o Rampa? La Mecánica Cuántica responde
Artículo basado en el libro: "La vida es física" de Alba Moreno.
5 min read


¿Alguna vez has hecho una fogata con tus amigos o familiares? Ya sea en la playa durante una calurosa noche de San Juan o en una oscura pero despejada noche de acampada, la respuesta mayoritaria a esta pregunta será afirmativa ¿Quién no se ha sentido atraído por el irrefrenable magnetismo del fuego en su niñez? Supongo que una gran mayoría, y es que durante muchos siglos, el fenómeno del fuego, aunque fascinante, también parecía perfectamente entendible: el calor genera luz, y tanto la intensidad como el color de las llamas dependerá de su temperatura. No obstante, a finales del siglo XIX, el fuego se convirtió en un problema inabordable por la comunidad científica. La problemática nacía de intentar explicar por qué los objetos calientes emiten luz, fenómeno conocido como “radiación del cuerpo negro”. Según las leyes físicas de ese momento, la intensidad de la luz emitida por un cuerpo (su radiación) aumentaría sin límites conforme aumenta la temperatura del cuerpo. Es decir, que cuando un cuerpo está cada vez más caliente, su energía emitida será mayor; además, la frecuencia de esa radiación será más alta. Esto conllevó a suponer que, en base a los postulados de la física clásica, un cuerpo muy caliente emitirá una cantidad de energía infinita con una radiación de frecuencia muy alta (como la ultravioleta), por ello, este problema recibió el nombre de “catástrofe ultravioleta”. Por suerte para la comunidad científica, la mecánica cuántica apareció en escena para solventar el problema.
En esos momentos de incertidumbre ante las bases de la física clásica que originaban conclusiones absurdas, es cuando apareció la figura de Max Planck, quien tomó una decisión muy arriesgada para cambiar nuestra comprensión del mundo. Planck propuso que la energía no se emite de forma continua, sino que lo hace en pequeñas cantidades discretas a las que denominó cuantos. Además, introdujo una nueva constante fundamental, que hoy denominamos constante de Planck (h). Veámoslo con un ejemplo: imagina que subes por una escalera, está claro que no puedes colocar tu pie a cualquier altura como si fuese una rampa, sino que deberás ir pisando cada uno de los peldaños y, además, lo tienes que hacer en orden. Aunque subas los escalones de dos en dos, siempre tendrás que seguir ese orden. De esta forma, cada escalón representa un nivel específico que puedes alcanzar, dejando claro que no existe la posibilidad de que te quedes en el espacio entre los peldaños. Planck afirmó que a la energía le ocurría lo mismo, solo pueden existir cantidades específicas de energía (escalones) o paquetes de energía que reciben el nombre de cuantos. Con esta palabra nació la mecánica cuántica, pero aún quedaba mucho por descubrir, y aún más por explicar.
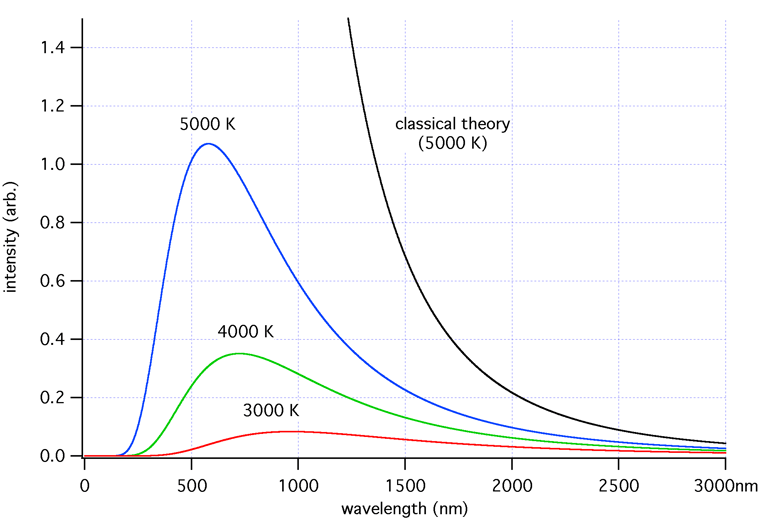
Intensidad de la radiación vs longitud de onda (Fuente: Wikimedia Commons)
Otro de los problemas que surgía de la física clásica, tenía que ver con el efecto fotoeléctrico. Este efecto ocurre cuando la luz incide sobre ciertos metales, lo que hace que el metal libere electrones. Según la teoría clásica, cuanto mayor fuese la intensidad de la luz, mayor sería la energía de los electrones expulsados. Sin embargo, los experimentos demostraron que el brillo de la luz (su intensidad) no importaba, sino que lo que verdaderamente determinaba que los electrones fueran liberados con una alta energía, era el color de la luz, es decir, su frecuencia. De esta forma, la luz ultravioleta (con alta frecuencia) aunque su intensidad fuese débil, sería capaz de arrancar más electrones que una luz roja (baja frecuencia) con mayor intensidad. Este descubrimiento fue realizado por el coloso de la física, Albert Einstein, quien sugirió que la luz no era una onda continua como se pensaba, sino que estaba formada por pequeñas partículas denominadas fotones, cada uno con una energía proporcional a su frecuencia.
La mecánica cuántica también le sirvió al danés Niels Bohr para el desarrollo de su modelo atómico. Si los electrones se encontraban dando vueltas en orbitas aleatorias alrededor del núcleo como se suponía, estos deberían colapsar o caer en el núcleo debido a la acción de la atracción eléctrica entre las cargas negativas de estos electrones y las positivas de los protones del núcleo. Según la teoría clásica, los electrones en movimiento deberían perder energía de forma continua y caer hacia el núcleo en un movimiento en espiral, lo cual contradecía la enorme estabilidad de la mayoría de átomos. Para resolver este problema, Bohr propuso que los electrones solo podían ocupar ciertos niveles de energía discretos, al igual que tú subes una escalera por cada uno de sus peldaños. De esta manera, los electrones sólo podrían acceder a un nivel energético superior cuando absorbían un cuanto de luz, y solo podían bajar a un nivel inferior, cuando lo emitían. Bohr visualizaba el átomo como un sistema solar en miniatura, donde los electrones sólo podrían orbitar en trayectorias concretas y solo podrían cambiar de órbita si reciben o emiten una cantidad exacta de energía. Con esta idea, Bohr pudo explicar los espectros de emisión de los diferentes átomos. Por ejemplo, en el caso del hidrógeno, cuando sus átomos son excitados emiten luz en los colores correspondientes a las transiciones de su único electrón de una órbita a otra. Como cada elemento tiene diferente número de protones, si uno de sus átomos es neutro, también tendrán diferente número de electrones, lo que genera que cada elemento presente un espectro de emisión específico, una especie de código de barras. Gracias a esta característica somos capaces de conocer los elementos presentes en las atmósferas de diferentes planetas, ¿o acaso creías que alguien había ido al sol para certificar que está principalmente compuesto de hidrógeno y helio?
Las teorías de Planck, Einstein y Bohr, demostraron que en las escalas más pequeñas, el cosmos está cuantizado: la energía, la luz e incluso el comportamiento atómico están determinados por pasos discretos y no continuos, se parecen más a una escalera que a una rampa.
Artículo basado en:






